CEMIPLIMAB
Prima stesura 29/6/2022; ultimo aggiornamento: luglio 2022
Nome commerciale
Libtayo ®
Compagnia farmaceutica produttrice
Libtayo ® è stato sviluppato dalla cinese Regeneron e dal gruppo francese Sanofi, nell’ambito di un accordo globale di collaborazione.
Indicazione approvata dal SSN
Cemiplimab, oltre che nel trattamento di alcuni tumori cutanei, è indicato, in monoterapia, per il trattamento di prima linea di pazienti adulti con carcinoma del polmone non a piccole cellule (NSCLC), con espressione di PD-L1 (in più del 50% delle cellule tumorali), senza aberrazioni EGFR, ALK o ROS1, che presentano:
– NSCLC localmente avanzato e non sono candidati per la chemio-radioterapia definitiva, oppure
– NSCLC metastatico.
Come da: documento AIFA sulle caratteristiche del prodotto.
Caratteristiche chimico-farmacologiche
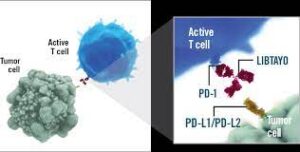
E’ un anticorpo monoclonale che si lega al recettore della morte programmata-1 (PD-1), bloccando il checkpoint immunitario PD-1/PD-L1 (formula: C6380H9808O2000S44) con peso molecolare di 143,6 kD.
Meccanismo d’azione
Inibisce la crescita tumorale mediante un meccanismo immunomediato, e, più in particolare, mediante l’inibizione del recettore 1 della morte programmata (PD-1). Grazie al blocco del legame di PD-1 con i suoi ligandi PD-L1 e PD-L2, si ha il ripristino della funzione citotossica dei linfociti T con conseguente potenziamento dell’attività antitumorale.
Modalità di somministrazione
La dose raccomandata è 350 mg ogni 3 settimane, somministrata mediante infusione endovenosa di 30 minuti.
Attività antitumorale riconosciuta
Come già detto, il farmaco è attivo nella terapia del NSCLC con espressione del PD-L1 in oltre il 50% delle cellule tumorali, ma lo è anche nel carcinoma squamoso della cute e nel carcinoma basocellulare.
Attività antitumorale (cancro al polmone)
Il Libtayo ® è stato ampiamente studiato in una serie di studi clinici chiamati EMPOWER.
In particolare, lo studio EMPOWER-Lung 1 ha recentemente confermato che la monoterapia con Cemiplimab è in grado di migliorare significativamente la sopravvivenza globale e la sopravvivenza libera da progressione, rispetto alla chemioterapia, nei pazienti con carcinoma polmonare avanzato non a piccole cellule con PD-L1 di almeno il 50%, fornendo una potenziale nuova opzione di trattamento per questa popolazione di pazienti.
Indicazioni cliniche
Vedi su.
Effetti tossici e collaterali
Gli effetti collaterali sono stati dichiarati “accettabili” dai ricercatori e comunque non superiori a quelli di altri farmaci della stessa categoria. Gli effetti collaterali più comuni includono stanchezza, eruzione cutanea, diarrea, dolori muscolo-scheletrici, anemia e nausea. Per maggiori informazioni si rimanda al documento AIFA sulle caratteristiche del prodotto.
Nostri articoli
//
Altre letture consigliate
//
Nome commerciale
Nexavar ®
Compagnia farmaceutica produttrice
Sviluppato da Onyx Pharmaceuticals, Inc. e commercializzato in Europa da Bayer.
Indicazione approvata dal SSN
Pazienti con carcinoma a cellule renali avanzato, dopo fallimento terapeutico di una precedente terapia a base di interferone alfa o interleuchina-2, o che sono considerati non idonei a ricevere tale terapia. Il Sorafenib è indicato anche per il trattamento dell’epatocarcinoma ed il carcinoma tiroideo differenziato. Allo stato, il Nexavar® non è approvato per il trattamento del cancro del polmone.
Caratteristiche chimico-farmacologiche
E’ una piccola molecola.
La sua formula chimica è: C21H16ClF3N4O3. Ha un peso molecolare di 450,34 g/mol.
Meccanismo d’azione
Il Sorafenib è un inibitore delle chinasi che determinano la proliferazione delle cellule tumorali in vitro. Inibisce la crescita di un ampio spettro di tumori umani, anche attraverso una riduzione dell’angiogenesi tumorale. I suoi bersagli a livello delle cellule tumorali sono i seguenti: CRAF, BRAF, V600E BRAF, c-KIT e FLT-3), mentre a livello dei vasi sanguigni del tumore sono: CRAF, VEGFR-2, VEGFR-3 e PDGFR-ß.
Modalità di somministrazione
Orale, compresse da 200 mg. La dose raccomandata per gli adulti è di 400 mg (due compresse da 200 mg) due volte al giorno (equivalente a una dose totale giornaliera di 800 mg). Va somministrato senza interruzione, fino a quando si osserva un beneficio clinico, o finché non compaiono tossicità inaccettabili.
Attività antitumorale riconosciuta
Sia la FDA americana e la EMA europea danno la stessa indicazione approvata dal nostro SSN. Allo stato, nessuna agenzia del farmaco governativa ha approvato il Nexavar® per il trattamento del cancro del polmone.
Attività antitumorale (cancro al polmone)
In uno studio di fase II su pazienti precedentemente trattati per un cancro al polmone non a piccole cellule (NSCLC), il Sorafenib in monoterapia risultò possedere una capacità di controllo della malattia e garantire sopravvivenza confrontabile a quella di altre piccole molecole ad azione mirata. In più il Sorafenib pare essere efficace anche quando dato in combinazione alla chemioterapia o ad altri inibitori delle tirosinchinasi. Nel mondo, non vi è attualmente una sola sperimentazione clinica in corso sul Sorafenib, come censito dai NIH. In effetti, un discreto numero di studi sono già conclusi e i loro risultati pubblicati (51 pubblicazioni scientifiche: censimento del 19/8/19, su PubMed).
Indicazioni cliniche
Nessuna allo stato.
Effetti tossici e collaterali
Le reazioni avverse più comuni sono state diarrea, rash, alopecia e sindrome mano-piede (corrispondente in MedDRA alla “sindrome da eritrodisestesia palmo-plantare). Per maggiori informazioni, si veda la scheda tenica dell‘EMA
Nostri articoli
//
Altre letture consigliate
FARMACI MIRATI

